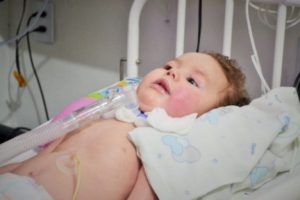
Antoniê Gabriel é uma criança quixadaense portadora de AME Tipo I que afeta em média somente 1 em cada 10.000 bebês nascidos vivos foto: Revista Central
Chega ao mercado brasileiro uma esperança para pessoas acometidas pela Atrofia Muscular Espinhal 5q (AME), doença que ataca o sistema nervoso até o ponto de o paciente não conseguir se mover ou mesmo respirar e que atinge um em cada dez mil bebês nascidos. A Anvisa publicará na segunda-feira (28/8) o registro do medicamento novo SPINRAZA® (nusinersena), na forma farmacêutica solução injetável e concentração de 2,4 mg/mL. Dessa forma, o Spinraza poderá ser comercializado no Brasil. A decisão será publicada no Diário Oficial da União (DOU).
O medicamento é indicado para o tratamento de pacientes com AME, doença rara neuromuscular autossômica recessiva de prognóstico adverso, caracterizada pela degeneração de neurônios motores da coluna vertebral e sem opções terapêuticas disponíveis no Brasil. O Spinraza é fabricado pelas empresas Vetter Pharma – Fertigung GmbH & Co. KG (Alemanha) e Patheon Itália S.PA (Itália). A detentora do registro do medicamento no Brasil é a empresa Biogen Brasil Produtos Farmacêuticos Ltda.
O processo de registro do medicamento recebeu prioridade de análise assim que foi protocolado junto à Anvisa, com o imediato início da avaliação tanto da documentação referente à comprovação de segurança e eficácia, quanto do dossiê de tecnologia farmacêutica. “É um medicamento que muda a história da AME, dando uma possibilidade concreta de melhora significativa na qualidade de vida dos portadores dessa doença”, ressalta o diretor-presidente da Anvisa, Jarbas Barbosa.
Como se trata de uma substância inédita no país, foi um processo mais complexo, envolvendo a avaliação crítica de informações legais e técnicas. Mesmo assim, dado o caráter prioritário que a Anvisa impôs, a análise foi feita de maneira célere, com o registro sendo concedido em cinco meses desde sua solicitação junto à Agência. Menos tempo do que levou o processo no Canadá, por exemplo, onde o registro do Spinraza saiu após cerca de seis meses.
O diretor de Autorização e Registro Sanitário da Anvisa, Fernando Mendes, ressalta a importância da concessão desse medicamento, registrado com os devidos parâmetros de segurança, qualidade e eficácia. Mendes trata o tema como prioritário: “A Agência está em vias de concluir a regulamentação que objetiva facilitar e também incentivar, no Brasil, a condução mais rápida de pesquisas clínicas e o registro de medicamentos destinados ao tratamento de doenças raras”.
Sobre Antoniê Gabriel.
Antôniê Gabriel é uma criança quixadaense de 1 ano e 8 meses portador de Atrofia Muscular rEspinhal Tipo I, uma doença rara que afeta em média apenas 1 em cada 10.000 bebês nascidos vivos. As pernas destas crianças tendem a ficar mais fracas que os braços, o que faz com que não se consigam sentar sem apoio nem segurar as suas cabeças, que por sua vez leva ao aparecimento de dificuldades na deglutição e na sucção.
Há algum tempo os familiares de Gabriel realizam campanhas e pedem doações para arrecadar o dinheiro necessário para a compra do medicamento que antes só era comercializado fora do Brasil, e as seis doses necessárias para o início do tratamento custariam nada menos do que R$ 3 milhões de reais.
Com a liberação da comercialização do medicamento no país, a família de Antoniê Gabriel ganha uma nova esperança de que finalmente consigam o medicamento para o tratamento da pequena criança.









